Agregar ácido para reducir la acidez en los aceites de materia prima: el proceso contradictorio de esterificación catalizada por ácido
Posiblemente el obstáculo químico más común al que se enfrentan los productores de biodiésel sea la presencia de ácidos grasos libres (FFA) en la materia prima (aceite vegetal o animal, incluido, entre otros, el aceite de cocina usado). En su forma más común, la producción de biodiésel utiliza un catalizador básico como el NaOH, el KOH o el metóxido de sodio para catalizar la reacción de transesterificación. Estos catalizadores reaccionan rápidamente con los ácidos grasos libres para formar jabones. Esto no solo consume los catalizadores antes de que tengan la oportunidad de catalizar la transesterificación, sino que forma una gran cantidad de jabones que pueden ser casi imposibles de eliminar. Tras la neutralización, cada 1% de FFA de la materia prima produce aproximadamente un 1,11% de jabón. Dependiendo del método de purificación del producto, cada 1% de jabón formado durante la reacción de transesterificación reduce el rendimiento del producto final en al menos un 2%. Teniendo en cuenta que la grasa amarilla puede tener hasta un 15% de contenido de FFA, es esencial reducir esta concentración antes de iniciar la reacción de transesterificación.
La forma más común de realizar esto para concentraciones relativamente bajas de FFA es mediante un proceso conocido como esterificación catalizada por ácido. En este proceso, se agrega un alcohol (normalmente metanol) a la materia prima junto con un catalizador ácido (más comúnmente ácido sulfúrico). La reacción de esterificación resultante produce ésteres metílicos (biodiésel) y agua con la siguiente reacción.
Tenga en cuenta que, si bien en el lado de los productos de la reacción, ambas especies son relativamente neutras, en el lado de los reactivos, tenemos una especie ácida (el FFA). Por lo tanto, cuanto más avance la reacción, menos ácida será la mezcla en general. Sin embargo, como puede verse, se trata de una reacción reversible. Esto significa que, a medida que aumenta la concentración de productos (biodiésel y agua) y disminuye la cantidad de reactivos (FFA y metanol), la reacción encontrará el equilibrio y dejará de avanzar hacia los productos. *
Teniendo en cuenta estos factores, resulta evidente que es muy importante tener la materia prima lo más seca posible al iniciar la reacción para que pueda avanzar en la medida de lo posible y reducir el contenido de FFA de la materia prima tanto como sea posible (véase el gráfico sobre la relación entre el FFA y el agua). En los casos en los que la materia prima comienza con un alto contenido de agua, la reacción no avanza en absoluto o incluso puede tener el efecto neto de aumentar la acidez de la materia prima. Este efecto se puede observar con frecuencia con tan solo un 0,5% de contenido de agua en la materia prima.
También es evidente que, en la medida en que los costes lo permitan, vale la pena añadir un gran exceso de metanol para impulsar el equilibrio de la reacción hacia los productos tanto como sea posible.
Finalmente, incluso si la materia prima está muy seca al principio y hay un gran exceso de metanol, la reacción siempre alcanzará el equilibrio antes de que se consuma todo el FFA. Cuanto mayor sea el contenido de FFA inicial de la materia prima, más FFA permanecerán después de la esterificación. Además, el agua producida en esta reacción también interfiere en cierta medida con la posterior reacción de transesterificación. Por lo tanto, en la industria del biodiésel es raro ver niveles iniciales de ácidos grasos libres por encima del 10% tratados previamente de esta manera.
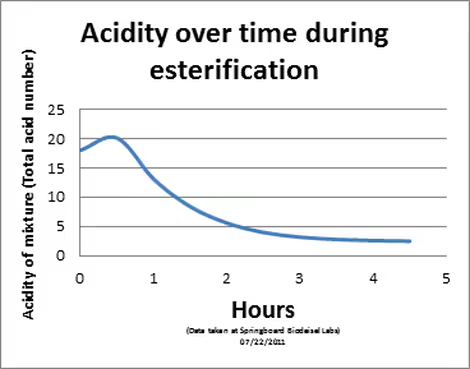
Se adjunta un gráfico de la acidez de una muestra de materia prima mezclada con metanol al 30% (vol/vol). Observamos un ligero aumento en el índice promedio de acidez total (expresado en mg de KOH/g de fluido) de la mezcla durante los primeros 30 minutos debido a la acidez del ácido sulfúrico utilizado como catalizador. Sin embargo, transcurridas 4 horas desde el inicio de la reacción, la acidez total de la mezcla es solo alrededor de 1/7 de la acidez original de la materia prima. La mayor parte de esta acidez restante se debe al catalizador de ácido sulfúrico residual. Este ácido sulfúrico se neutraliza rápidamente para formar Na2ASÍ QUE4 (también conocida como sal) al inicio de la reacción catalizada por una base. Esta sal se elimina muy fácilmente del combustible y no afecta significativamente al rendimiento del producto final.
* En esta reacción en particular, es casi exclusivamente el agua lo que impide el progreso hacia adelante. La concentración del biodiésel parece tener muy poco efecto. Esto se debe a sus diferencias de solubilidad con el metanol y el H2ASÍ QUE4.












.svg)
