Ajouter de l'acide pour réduire l'acidité des huiles de base : le processus contre-intuitif d'estérification catalysée par un acide
L'obstacle chimique le plus courant rencontré par les producteurs de biodiesel est probablement la présence d'acides gras libres (AGL) dans la matière première (huile végétale ou animale, y compris, mais sans s'y limiter, l'huile de cuisson usagée). Dans sa forme la plus courante, la production de biodiesel utilise un catalyseur basique tel que le NaOH, le KOH ou le méthoxyde de sodium pour catalyser la réaction de transestérification. Ces catalyseurs réagissent rapidement avec les acides gras libres pour former des savons. Non seulement cela consomme les catalyseurs avant qu'ils n'aient la chance de catalyser la transestérification, mais cela forme une grande quantité de savons qui peuvent être presque impossibles à éliminer. Lors de la neutralisation, chaque 1 % d'AGL présent dans la matière première produit environ 1,11 % de savons. Selon la méthode de purification du produit, chaque 1 % de savon formé pendant la réaction de transestérification réduit le rendement du produit final d'au moins 2 %. Étant donné que la graisse jaune peut contenir jusqu'à 15 % de FFA, il est essentiel de réduire cette concentration avant de démarrer la réaction de transestérification.
La méthode la plus courante pour y parvenir pour des concentrations relativement faibles d'AGL est d'utiliser un processus connu sous le nom d'estérification catalysée par un acide. Dans ce processus, un alcool (généralement du méthanol) est ajouté à la matière première avec un catalyseur acide (le plus souvent de l'acide sulfurique). La réaction d'estérification qui en résulte produit des esters méthyliques (biodiesel) et de l'eau avec la réaction suivante.
Notez que du côté des produits de la réaction, les deux espèces sont relativement neutres, du côté des réactifs, nous avons une espèce acide (la FFA). Ainsi, plus la réaction avance, moins le mélange global sera acide. Comme on peut le constater, il s'agit d'une réaction réversible. Cela signifie qu'à mesure que la concentration des produits (biodiesel et eau) augmente et que la quantité de réactifs (FFA et méthanol) diminue, la réaction trouvera son équilibre et cessera de progresser vers les produits. *
Compte tenu de ces facteurs, il apparaît qu'il est très important que la matière première soit aussi sèche que possible lors du démarrage de la réaction afin qu'elle puisse avancer le plus loin possible et réduire autant que possible la teneur en FFA de la matière première (voir le graphique sur la relation entre les FFA et l'eau). Dans les cas où la matière première commence avec une forte teneur en eau, la réaction ne progresse pas du tout ou peut même avoir pour effet net d'augmenter l'acidité de la matière première. Cet effet peut souvent être observé avec une teneur en eau aussi faible que 0,5 % de la matière première.
Il apparaît également que, dans la mesure où les coûts le permettent, il est intéressant d'ajouter un excès important de méthanol afin de ramener autant que possible l'équilibre réactionnel vers les produits.
Enfin, même si la matière première est très sèche au départ et qu'il y a un excès important de méthanol, la réaction atteindra toujours l'équilibre avant que tous les FFA ne soient consommés. Plus la teneur en AGL de départ de la matière première est élevée, plus il en restera après l'estérification. De plus, l'eau produite lors de cette réaction interfère également dans une certaine mesure avec la réaction de transestérification ultérieure. Il est donc rare de voir des niveaux initiaux d'AGL supérieurs à 10 % prétraités de cette manière dans l'industrie du biodiesel.
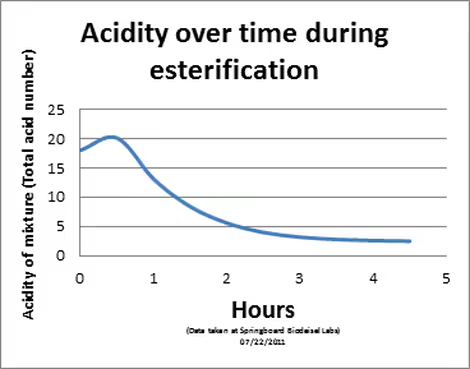
Vous trouverez ci-joint un graphique de l'acidité d'un échantillon de matière première mélangée à 30 % de méthanol (vol/vol). Nous constatons une légère augmentation de l'indice d'acide total moyen (exprimé en mgKOH/g de liquide) du mélange au cours des 30 premières minutes en raison de l'acidité de l'acide sulfurique utilisé comme catalyseur. Cependant, dans les 4 heures suivant le début de la réaction, l'acidité totale du mélange n'est que d'environ 1/7e de l'acidité initiale de la matière première. La majeure partie de cette acidité restante est due au catalyseur d'acide sulfurique résiduel. Cet acide sulfurique est rapidement neutralisé pour former du Na2DONC4 (alias sel) au début de la réaction catalysée par la base. Ce sel s'élimine très facilement du combustible et n'affecte pas de manière significative le rendement du produit final.
*Dans cette réaction particulière, c'est presque exclusivement l'eau qui empêche la progression. La concentration du biodiesel semble avoir très peu d'effet. Cela est dû à leurs différences de solubilité avec le méthanol et H2DONC4.












.svg)
